前请提要:http://www.shbio.com/articles/3013
上一期小编给大家分享了编辑部评论文章,介绍了克服新冠病毒变异潜在耐药性的方法。今天小编继续带领大家欣赏本期 Cell Research 上的 RNA 甲基化研究成果。希望通过以下 RNA 甲基化研究文献的研读,明确在该期刊上发表文章需要做到的深度和采用的技术手段。当然,重要的是通过这篇文章,一起了解一下伯豪公司能够在该领域带给大家什么技术服务。

好了,开始本期的文献之旅~

m6A-dependent biogenesis of circular RNAs in male germ cells
雄性生殖细胞中 m6A 依赖的 环状 RNA 生物发生
摘要:
大部分从编码基因剪接而来的环状 RNA (circRNAs) 大部分含有开放阅读框(ORFs),因此具有编码蛋白质的潜力。目前还不清楚是什么调控了这些含 ORF 环状 RNA 的生物发生。作者在研究中报道了小鼠精子形成过程中有大量环状 RNA 的合成,当晚期粗线精母细胞发育成圆形,进而拉长为精子细胞时,环状 RNA 的丰度增加。对于一部分环状 RNA 来说,反剪接似乎主要发生在富含 m6A 的位点,这些位点通常位于线性 mRNA 的起始密码子和终止密码子周围。大约一半的雄性生殖细胞中带有大型 ORF 的环状 RNA 在其连接处含有 m6A 修饰的起始密码子,这些特征近期被证明与蛋白质编码潜能有关。利用液相色谱 - 质谱联用技术检测了这些环状 RNA 连接序列编码的数百个多肽,表明这些环状 RNA 确实可以在发育中的(精母细胞和精子)和成熟的(精子)男性生殖细胞中被翻译成蛋白质。本研究不仅发现了 m6A 在编码环状 RNA 的生物发生中发挥的新作用,而且还发现了一种潜在的机制:可以在没有线性信使 RNA 的情况下,确保稳定和持久的蛋白质生产,即通过产生包含大型 ORFs 的环状 RNA,并在连接处具有 m6A 修饰起始密码子。
研究结果
结果一:环状 RNA 在精子发生过程中大量表达
为了寻找小鼠生精细胞中整个的 RNA 转录组,作者分别在有或无 RNA 酶 R 处理情况下建立了 RNA 库,并基于两个原因采用了 RNA 深度测序:首先,作者希望看到核糖核酸酶 R 处理的 RNA-seq 是否会导致较高 circRNA 注释假阳性率。其次,是想用总的线性 RNA 作为 circRNA/ 连接 reads 标准化的内参。为了加强 circRNA 的发现比例,作者还采用了近期报道的一种 circRNA 富集方法:RNAse R 处理,然后进行聚腺苷酸化和 poly A + RNA 耗竭(RPAD)。RPAD 方法选择性地去除了大部分的线性 mRNA,从而从总 RNA 中富集环状 RNA,用于构建文库和深度测序。两种传统的 RNA-seq 方法在三种生精细胞类型(粗线精母细胞、圆形和伸长的精子细胞)中环状 RNA 的总体表达模式相似,总共有 65,500 个环状 RNA 从 rpad -seq 数据中被注释。重要的是,从常规 RNA-seq 数据中识别出的环状 RNA 中,约 80% 可以在 rpad -seq 数据中得到验证,说明两种方法的假阳性率相似。考虑到合适的归一化方法和有限的起始材料,作者决定在以下所有分析中,主要使用从传统 RNA-seq 数据中识别的环状 RNA(不使用 RNAse R 处理)。
结果二:CircRNA 水平随着精子发生的进展而增加
越来越多的数据表明,在精子发生过程中,mRNA 转录本的整体缩短是通过多聚腺苷酸化信号的活化和精细胞中长 3'UTR 转录本的选择性降解来实现的。circRNA 的产生与剪接活性呈正相关。考虑到精子发生的进程从晚期减数分裂到单倍体阶段选择性剪接的增强,作者首先测试了环状 RNA 的生物发生的提高是否也发生在这一阶段。作者发现,当粗线精母细胞发育成圆形 / 拉长的精子细胞时,独特环状 RNA 的数量(图 1a) 和相对丰度(图 1b,) 都急剧增加。
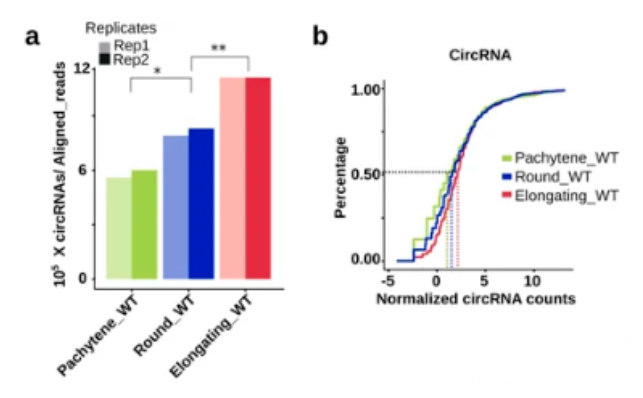
有趣的是,它们相应的线性形式的水平从粗线精母细胞到圆形 / 拉长的精子细胞这一过程下降,环状 / 线形比率显著增加。
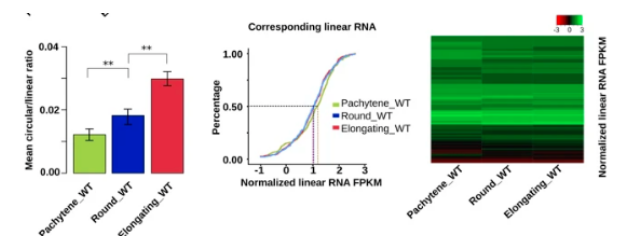
作者通过检测三种精子形成所必需基因(Ddx4、Spag16 和 Trim37) 的线状和环形水平来实验验证这一发现。这些数据表明,从粗线精母细胞和圆形精子细胞退化为细长精子细胞时,环状 RNA 的水平会升高。
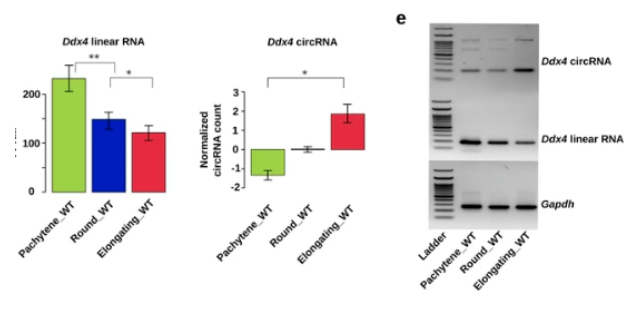
GO 富集分析显示,这些环状 RNA 的宿主基因参与了精子发生过程中的关键事件,如表观基因组调控(DNA 甲基化、组蛋白修饰和核小体组织)和精子运动(纤毛运动、轴突组装和微管束形成)。环状 RNA 的半衰期要比线性 RNA 长得多,因为它们缺乏自由末端,因而不易降解。考虑到线性 RNA,特别是那些具有较长 3’utrs 的 RNA,在精子发生后期正处于积极的降解过程中,环状 RNA 水平的升高可能代表了一种机制。通过这种机制,在精子发生的后期,某些具有特殊重要性的转录本可以被保留下来,用于蛋白质的生成。
重点来了!

结果三:CircRNA 的积累与 m6A 位点的剪接增强相关
近期的数据表明,m6A 参与调控体细胞和雄性生殖细胞的选择性剪接。在作者近期的研究中已经证明,ALKBH5 失活导致 WT 粗线精母细胞和圆形精子细胞中较长 mRNA 转录本被剪接成较短的转录本,这些较长的转录本中存在较高水平的 m6A。这表明 m6A 水平升高的 pre-mRNAs 似乎更紧密地结合剪接小体,从而导致增强的剪接。如果 m6A 参与了这一过程,则 m6A 水平应升高,而 ALKBH5 水平应降低。事实上,根据作者对 WT 生精细胞的 RNA-Seq 分析,从粗线精母细胞到圆形 / 拉长的精子细胞,Alkbh5 mRNA 水平确实下降。

为了进一步证实 ALKBH5 影响 circRNA 的产生,作者进行了体外的 ALKBH5 敲除和 minigene 报告基因测定。这些数据表明,抑制 ALKBH5 确实可能通过增强剪接来提高 circRNA 的产量。

为了进一步建立 circRNA 的产生与 m6A 水平之间的关系,作者进行了 m6A RNA 免疫沉淀,并进行了深度测序(m6A- RIP -seq) 分析。通过对 circRNA 丰度和 m6A 水平的分析,作者发现环状 RNA 越丰富,其所含 m6A 水平越高。这种正相关强烈提示我们环状 RNA 是从 m6A 富集位点剪接而来的。如果这个观点是正确的,那么 m6A 免疫沉淀产物应该含有丰富的环状 RNA。事实上,通过使用 m6A-RIP-seq reads 注释环状 RNA,作者观察到,圆形 / 线形比率从粗线精母细胞到圆形增加,然后到细长的精子细胞进一步增加。m6A- RIP -seq reads 的环状 / 线性比显著高于 RNA-seq,说明 m6A 的环状 RNA 连接区域明显富集。

作者将这些连接片段分为头(靠近 5' 端)和尾(靠近 3'端)片段,然后将它们映射到线性 mRNA 上。分析数据显示,这些 m6A - RIP 富集的环状 RNA 包含长度可变的 ORF,其中大多数拥有起始密码子,有些甚至同时拥有起始密码子和终止密码子。
结果四 一类环状 RNA 的 ORF 中含有 m6A 修饰的起始密码子
只有少数来自基因间区域的环状 RNA 被证明可以作为 miRNA 海绵,而大部分编码基因剪接的环状 RNA 含有 ORFs,因此具有蛋白编码的潜力。近期的一份报告表明,一些含有 ORF 的环状 RNA 可以通过 m6A 修饰的起始密码子作为内部核糖体进入位点(IRES) 有效地翻译成蛋白质,而 IRES 可以被 m6A 的读者 YTHDF3 识别。如果这些 RNA 环可以被翻译成蛋白质,那么将线性 mRNA 转化成具有编码能力的环状 RNA 将是绕过大量 mRNA 降解并维持某些蛋白质持续产生的理想机制,而这些蛋白质对晚期精子形成尤为重要。
在精子发生的减数分裂晚期和单倍体早期(粗线精母细胞→圆形精子细胞→细长精子细胞),环状 RNA 主要来源于外显子。有趣的是,通过将头部和尾部的连接处 reads 映射到全长的宿主线性 mRNA,作者观察到这些连接似乎在起始密码子和终止密码子(图 3b 中指向两个峰值的箭头)中都得到了富集,这表明这些环状 RNA 可能含有全长或部分 ORFs.

如果这些环状 RNA 是可翻译的,那么这意味着尽管线性 mRNA 大量降解,部分或全长蛋白仍可在伸长的精子细胞中产生。更有趣的是,作者还观察到具有更高的循环 / 线性比率的环状 RNA (即,circRNA 作为转录的主要输出)相对于那些低循环 / 线性比率(即,以线性 RNA 为主要转录输出)具有更多完整的 ORF。这些数据表明,这些含 ORF 的环状 RNA 可以逐渐取代它们的线性形式,这可能是为了即使在线性 mRNA 降解后,仍能维持蛋白质的连续生产。

接下来,作者研究了 m6A 修饰的起始密码子是否富集在这些环状 RNA 的连接位点。对生精细胞的 m6A-RIP-seq 分析显示,独特环状 RNA 的数量从粗线精母细胞到圆形和伸长的精子细胞演化过程中增加,并在伸长的精子细胞中达到峰值。进一步对宿主基因的头(5' 端)和尾(3'端)连接序列比对发现,在起始密码子周围存在丰富的 m6A,表明这些环状 RNA 确实含有 m6A 修饰的起始密码子。考虑到 m6A 修饰的起始密码子可以被 YTHDF3 识别并作为翻译起始的 IRES,这个发现表明这个环状 RNA 亚群可能是可翻译的。
综上所述,这些数据表明,在晚期减数分裂(精子母细胞)和单倍体(精子单体)男性生殖细胞中富集的环状 RNA,大多同时包含完整的 ORFs 和 m6A 修饰的起始密码子。这些环状 RNA 很可能是为了维持蛋白质的持续生产,这对晚期精子形成和精子功能至关重要。
结果五:ALKBH5 和 METTL3 通过调节 m6A 水平影响环状 rna 的生物合成
为了建立 m6A 和环状 rna 之间的因果关系,作者分析了来自 Alkbh5- 和 Mettl3-null 的数据。作为 m6A 的擦除剂,ALKBH5 已被证明在精子形成过程中起着关键作用。在 alkbh5 缺失的粗线精母细胞中,circRNA 的水平已经达到峰值。事实上,与 WT 对照组相比,alkbh5 缺失的生精细胞中圆形 / 线形比率明显上调。METTL3 起着 m6A 增加的作用,缺乏 METTL3 已被证明会导致减数分裂期的生精停滞和男性不育。如果 m6A 水平影响 circRNA 的产生,则 metll3 缺失的生精细胞中 circRNA 的生物发生应该被下调。这些数据进一步支持了 m6A 影响减数分裂和单倍体男性生殖细胞中环状 rna 产生的观点。
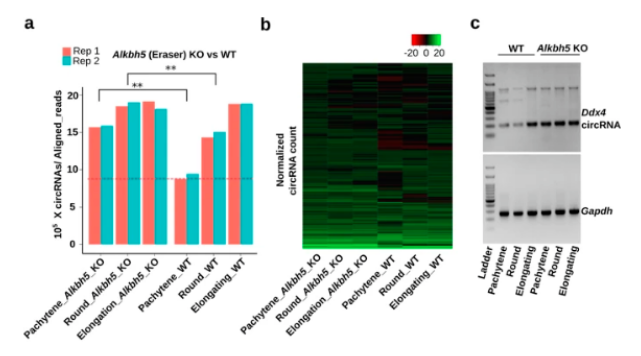
结果六:精子携带大量进化上保守的环状 RNA
考虑到环状 RNA 比线性 RNA 更稳定,作者推测 spermatozoa 中可能存在少量环状 RNA。令作者惊讶的是,环状 RNA 在精细胞中的含量是精母细胞和精原细胞的 50-100 倍。
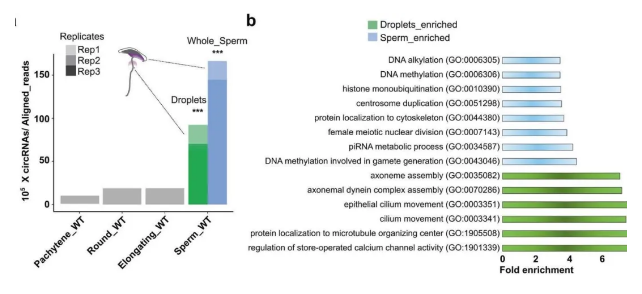
作者纯化了胞质液滴(CDs),这是一种只存在于附睾精子中的瞬时细胞器,作者发现 CDs 中也含有大量环状 RNA。作者分析了全精子和精子头部的 circRNA 含量,发现全精子中独特的 circRNA 数量是精子头部的 3 倍,说明大部分环状 RNA 定位于精子尾部和连接部位 / 颈部。作者还发现约 30% 的精源性环状 RNA 存在于伸长的精细胞中,说明精源性环状 RNA 来源于精子发生。
为了进一步探索 circRNA 在人类精子中的潜在作用,作者使用 RNA-seq 分析了 circRNA 在高生育(IVF 中妊娠率为 25%) 和低生育(IVF 中妊娠率 <10%) 人类精子中的表达。高生育能力的精子比低生育能力的精子含有更多的环状 RNA。与高生育能力精子相比,低生育能力精子中存在更多的线性 RNA。这些数据表明,精子中含有大量的环状 RNA,这些环状 RNA 可能在生命中发挥作用。
结果七:环状 RNA 在生精细胞和精子中都可以被翻译成蛋白质
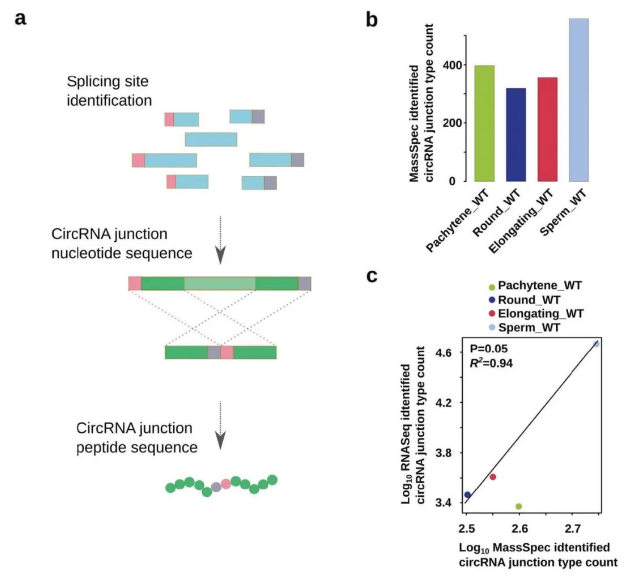
如上所述,环状 RNA 的翻译代表一种代偿机制,以确保晚期精子形成的关键蛋白的持续产生。然而,翻译的直接证据仍然缺乏。很难明确地证明环状 RNA 的翻译,因为环状 RNA 和它们的同源线性形式都具有相同的 ORFs。因此,作者无法区分检测到的肽的来源(环状 RNA 和它们的线性形式)。由于丰度极低,需要使用基于 LC-MS 的蛋白质组学方法来识别这些罕见但独特的连接肽。将 LC-MS 鉴定的所有肽段与数据库进行比对,从三种生精细胞类型和精子中鉴定出数百个高可信的连接肽(99%)。作者还在 NCBI 蛋白数据库中对这些连接肽进行了分析,发现只有 1 - 2 次比对上,表明假阳性率很低(<0.5%)。因此,大多数(99.8%) 的多肽是环状 RNA 的连接序列所特有的。这些数据有力地表明,男性生殖细胞环状 RNA 在减数分裂晚期和单倍体男性生殖细胞中积累,并为晚期精子形成和正常精子功能提供持续的蛋白质供应。
目前,RNA 甲基化是机制研究的热点,已有的研究表明 RNA 甲基化修饰发生在很多重要的生命进程中。RNA 甲基化检测的技术主要包括 LC-MS,m6A-seq,m6A-IP-PCR 等。伯豪生物现在已经具备提供 m6A-seq 服务的能力,而且富集实验得到的 motif GGAC 序列可以排在前三位,并且承诺如果不在前三位给客户免费重新富集。更为重要的是,为了解决前期 m6A-seq 检测的盲目性等问题,基于质谱分析的 m6A 检测也在紧锣密鼓的研发测试中,预计 4 月初就可以为广大客户提供检测服务。

阅读原文:https://mp.weixin.qq.com/s/ASXqSJr64FcSrUjqpVTDOA



