题目:BET inhibition blocks inflammation-induced cardiac dysfunction and SARS-CoV-2 infection
PMID:33811809 该研究涉及的组学内容:磷酸化蛋白质组学;单细胞核转录组学;
单细胞核转录组测序(sc-RNA-seq)的平台:10 x Genomics
实验研究对象:COVID-19 患者血清,人类心脏类器官 hCOs,K18-hACE2 小鼠,脂多糖 LPS 构建的 CS 小鼠模型。
该研究通过多模型数据结果综合分析阐述了 COVID-19 感染后患者心脏的病毒反应引起的心脏功能障碍的作用机制,并有针对性的探索这一过程中主效的两个蛋白分子的 3 处磷酸化修饰位点,同时针对这两个分子,探索了含溴抑制剂(尤其是 INCB054329)在这一过程中的治疗作用。接下来让我们详细了解下作者是如何应用多组学的思维进行这样一项大规模的系统性实验吧:
研究概述

COVID-19 感染的人群常伴有心脏损伤和功能障碍的发生,极大程度增加了死亡风险。但其导致心脏损伤及功能障碍的原因尚不清楚,推测可能是过度的炎症反应引发的。为了确定 COVID-19 治疗药物对心脏的保护机制, 作者使用了磷酸化蛋白质组学和单细胞核转录组测序(sn-RNAseq)相结合的方法, 围绕不同实验模式下的 心脏类器官 模型展开研究。确定了:干扰素 TNF-γ,白介素 IL-1β 的混合物诱发了心脏舒张功能障碍。该研究结果发现在 SARS-CoV- 2 感染后,含溴结构域的蛋白质 - 4 随病毒反应而被激活,并且该病毒反应在人心脏类器官 human cardiac organoids(hCOs)和 SARS-CoV- 2 感染的 K18-hACE2 小鼠心脏中的结果均一致。在含溴的抑制剂(BETi)作用下,感染 SARS-CoV- 2 的 hCOs 模型可恢复舒张功能。此外,BETi 抑制剂减少了病毒反应中病毒复制相关基因的转录,降低了 ACE2 蛋白的表达,并减少了心肌细胞的 SARS-CoV- 2 感染比率。本研究结果显示:包括食品和药物管理局(FDA)指定药物阿帕地韦在内的 BETi 抑制剂都是有望预防 SARS-CoV- 2 介导的心脏损害的候选药物。
主要研究思路
作者利用人类多能干细胞(hPSC)衍生出的心脏类器官(hCOs)模型,在体外模拟 Cov-19 引发炎症型心脏功能障碍模型以及对 BETi 治疗的 hCOs 模型开展研究。作者使用磷酸化蛋白质组学和单细胞核测序(sn-RNA-seq)相结合的方法,以确定心脏功能障碍的治疗靶点和治疗方法(图 1)。
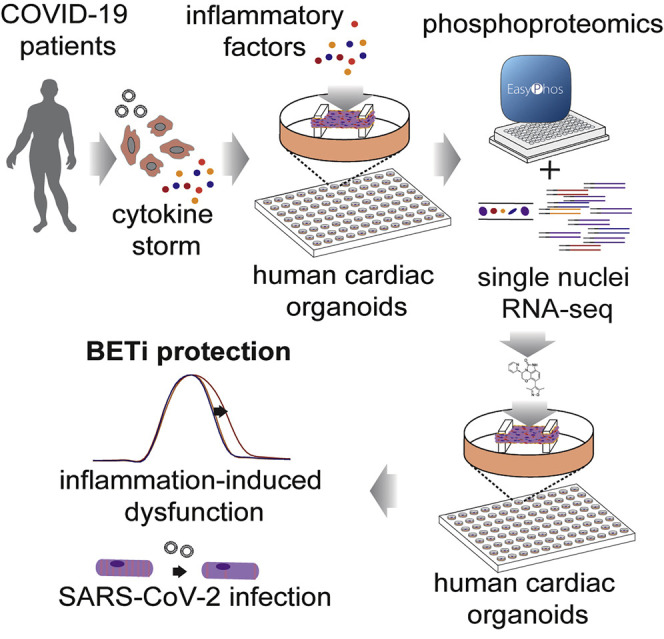
▲图 1 主要研究示意
结果数据
1. 磷酸化蛋白质组学技术:研究心脏细胞炎症反应引起的功能障碍的机制
从 COVID-19 患者中观察到的常见的心脏功能障碍类型是:右心室收缩功能障碍和左心室舒张功能障碍。作者重点研究了由 IFN-γ,IL-1β 和 poly(I:C)引起的舒张功能障碍。 作者使用 磷酸化蛋白质组学技术 测量了 hCOs 样本,鉴定出了 7,000 多个磷酸化修饰位点,发现与心脏功能障碍相关的炎性蛋白分子参与的生化反应过程中发生大量的磷酸化修饰(图 2)。作者对磷酸化修饰的结果中两个分子的三个位点展开了重点研究 [STAT1(S727)及 BRD4(S469)和(S1083)的两个位点](图 2B 和 2C)。(选择这些位点展开研究的理由:每种靶标或其上游调节剂均具有特定的小分子抑制剂)
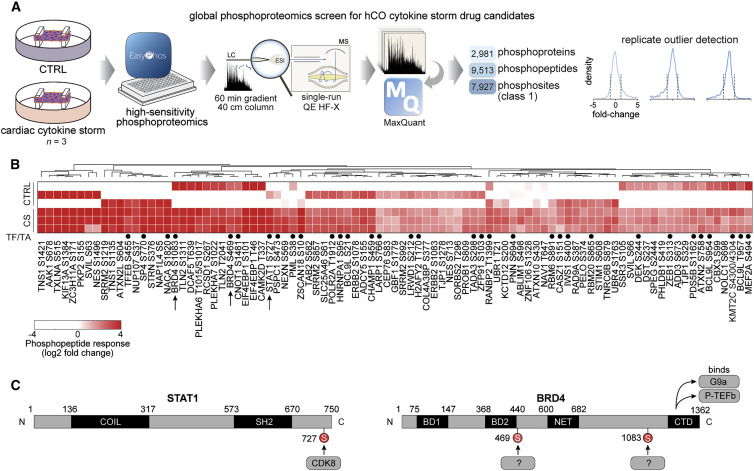
▲图 2 磷酸化蛋白质组学揭示了驱动心功能不全的信号
2. 应用 sn-RNA-seq 技术研究:验证磷酸化蛋白组学的结果的类群间异质性
在确定了初始研究目标后,作者继续使用 sn-RNA-seq 技术检测炎症因子刺激(CS)状态下 hCOs,其中成纤维细胞类群和激活的成纤维细胞类群的细胞数量增加(图 3B)。KEGG 通路分析显示:心肌细胞和成纤维细胞中,转录反应均以病毒感染的相关反应为主(图 3)。下调的基因较少且主要分布在成纤维细胞中,并由细胞外基质(ECM)基因(包括 COL1A1,COL3A1 和 COL4A5)控制(图 3)。转录反应高的是 STAT1 和 EP300 的一般表观遗传激活(图 3)。这与作者的磷酸蛋白质组学数据一致(图 2)。这些分析共同揭示了心脏在多个细胞群体中均发生了较强的病毒应激反应(图 3), 作者推测心脏的病毒应激反应是通过 STAT1 和 BRD4 的表观遗传激活介导的。
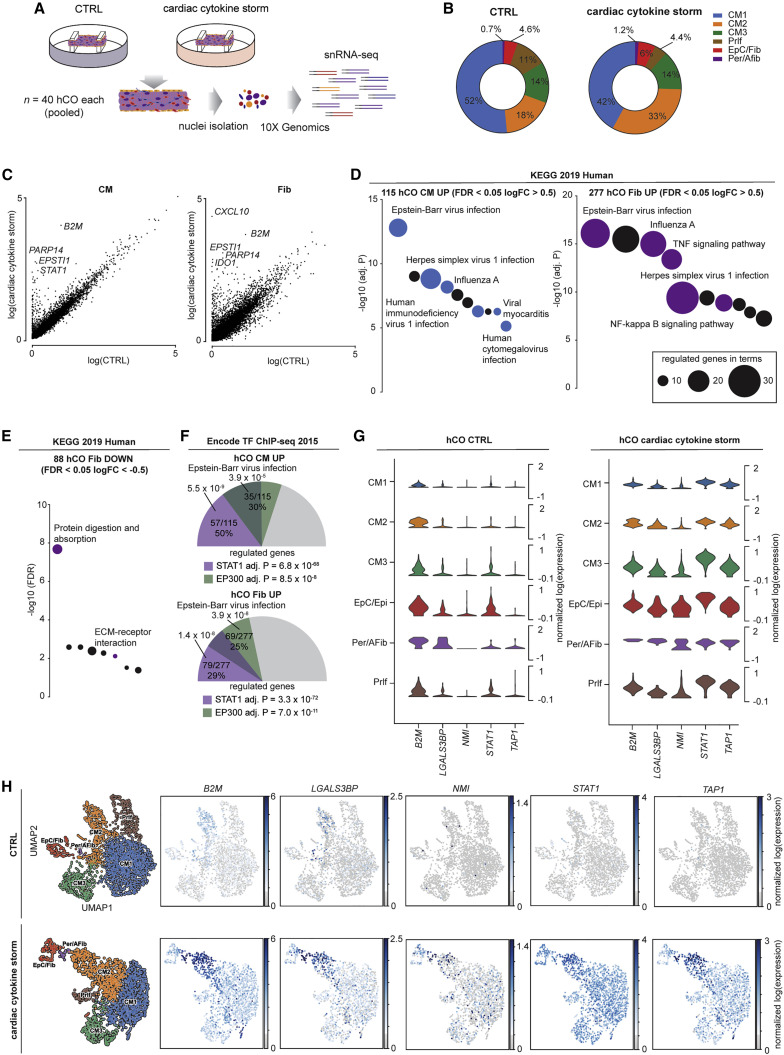
▲图 3 sn-RNA-seq 揭示 CS 激活人类心脏类器官(hCOs)的病毒反应
3. 应用 sn-RNA-seq 技术研究:预防和治疗心脏功能障碍的药物
该研究筛选了治疗: 由 TNF- γ 引起的收缩功能障碍或多重炎性细胞因子(CS)驱动的舒张功能障碍引起的 心脏功能障碍的药物 (图 4)。结果显示药物:Baricitinib 预防了 TNF- γ 诱导的 hCOs 收缩型功能障碍(图 4)。并且作者在 CS 处理的 hCOs 样本的磷酸蛋白质组数据中观察到 BRD4 的磷酸化水平升高,该结果与 snRNA-seq 分析的结果一致。在药物筛选过程中,引人注目的是:INCB054329 以剂量依赖的方式预防了 CS 引起的舒张功能障碍(图 4)。JQ- 1 还显示出一种 hPSC 系在高浓度下舒张功能得到改善,因此测试了 JQ- 1 和 ABBV-744 的其他更高浓度。尽管 INCB054329 是有效的。但是相比之下,ABBV-744 可能通过其作为雄激素受体抑制剂的双重作用而增加 hCOs 的舒张功能障碍,这与接受雄激素剥夺治疗的患者延长 QTc 有关。为了验证 BRD4 是否为靶标,作者使用了腺相关病毒 AAV(血清型 6)介导的短发夹(sh-RNA)递送,并证明大约 74% 的敲除可以减少 CS 治疗的 hCOs 中的舒张功能障碍。INCB054329 介导的 BETi 在 CS 病情 24 小时后挽救了功能异常的 hCOs 并恢复了舒张功能(图 4)。这可能是因为 CS 引起的舒张功能障碍是可逆的,并且是由炎症介质驱动的,这是通过去除 CS 因子后 24 小时 hCOs 部分恢复数据所证实的(图 4)。在患者中,所有炎性因子可能同时存在,该研究发现 INCB054329 可同时具有所有四种功能障碍诱导因子 TNF,IFN-γ,IL-1β 和 poly(I:C)减轻舒张功能障碍。综上所述,CS 通过依赖 BRD4 的机制介导舒张功能障碍,可使用(含溴抑制剂)BETi 阻断。因为 BRD4 在我们的 hCOs 中广泛表达(图 4)。
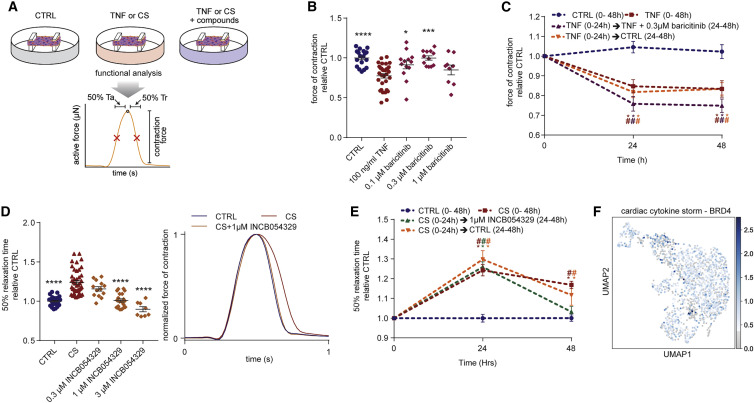
▲图 4 发现能改善心脏功能障碍的药物
总结
随后作者围绕这一结论展开了系统的体内实验验证,在体内实验验证中涉及了多种感染模型,小伙伴们若想了解本研究的更多细节 扫二维码下载原文及附件。

本次文献就解读到这里了,接下来为大家安利一款伯豪生物自主研发的抽核试剂: 伯优®细胞核分离试剂盒 。
伯豪生物自主研发的抽核试剂: 伯优®细胞核分离试剂盒 。可处理样本类型:人或其它哺乳动物新鲜或冻存的组织样本;优势:大限度的维持了细胞核核膜的完整以及染色质的空间结构,该试剂盒经多次重复性实验印证,在下列组织中具有得率高,杂质少及不易成团的特点,适用于:scATAC-seq/bulk ATAC-seq/snRNA-seq/bulk RNA-seq 等相关实验。
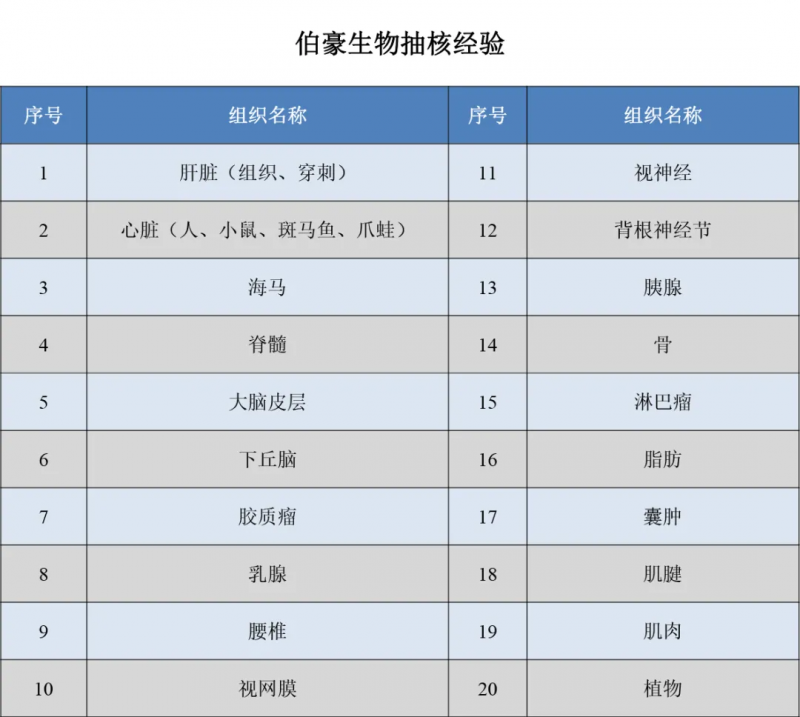
除了抽核试剂核外,伯豪生物还可为您提提供全方位的测序服务,若您有相关需求,请拨打伯豪生物服务热线:021-58955370,或与驻地销售人员沟通。
更多伯豪生物人工服务:


