
尽管转录组研究已经获得很多令人激动的进展,但它终归还是一个高度协调的、受表观基因组调控的基因表达程序的副产物。表观基因组是由 DNA 的染色质状态决定的,这种状态可以是开放的(可及的),也可以是封闭的(不可及的)。染色质状态影响了 DNA 结合蛋白(如转录因子或 RNA 聚合酶)如何与基因组 DNA 相互作用,这意味着表观基因组调控不仅可以影响发育方向、疾病进展和治疗反应,还往往发生在转录变化之前,并可用来揭示其他方法难以区分的细胞类型。
研究人员已经利用单细胞 ATAC(转座酶可及性染色质分析)来鉴定样本中的调控元件。如今为了更深入的了解细胞身份,许多研究人员正在尝试获取一种综合细胞开放染色质图谱和基因表达谱的统一视图。有些研究人员将样本一分为二,用单细胞 RNA-seq 处理一半样本,用单细胞 ATAC-seq 处理另一半样本,从而同时获得转录组和表观基因组信息。然后,他们据此推断哪些类型的细胞在两个数据集中相互对应。然而,这种方法在很大程度上依赖于转录起始位点、启动子位置和基因表达水平之间关系的假设,以及有关不同类型细胞的表观遗传学特征的先验信息。此外,处理两份样本的不同流程之间的差异也可能会影响细胞状态和结果。设想一下另一种选择,您可以在同一时间分析同一个细胞中的这两种模式。不需要推断,不需要等待生物信息学家来对配对结果进行分析,即使在细胞数量很少时,也不需要反复纠结应该优先采用哪种检测。
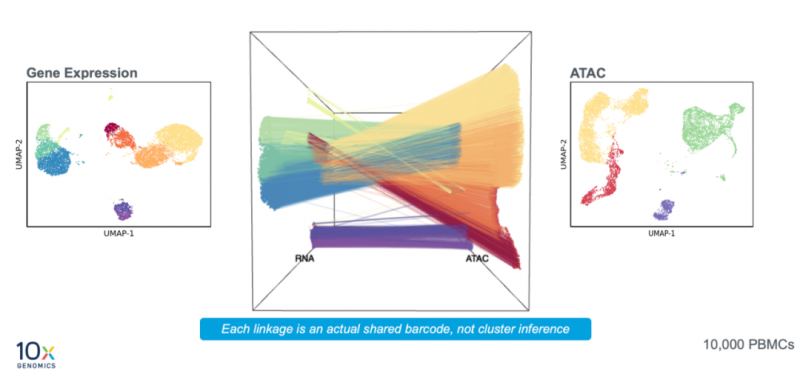
全新的 Chromium 单细胞多组学 ATAC + 基因表达,就能够实现这一点。该产品可同时捕获同一单细胞的转录组和表观基因组,为您提供所需的、足够深入的信息去鉴定基因表达模式、细胞类型,以及细胞状态是如何建立的。您能够对样本进行更加深入、高置信度地分析,从而借助关键的基因表达标志物,您可以发现新的基因调控相互作用,或更好地解释表观遗传特征。

让我们想象一种场景,假设一名癌症研究人员想了解治疗耐药性背后的机制。分别对有应答和无应答患者样本的相同细胞进行 mRNA 表达和染色质景观图谱分析,他们能够鉴定肿瘤特异性的转录因子和关键调控元件的激活,然后通过相关的基因表达变化将它们与下游目标基因关联起来。这些信息将有助于阐明引起耐药性的癌细胞特异性的基因调控程序和基因表达特征。当然,这仅仅是一个使用案例。让我们再深入思考一下:单细胞多组学 ATAC + 基因表达如何揭示驱动免疫细胞谱系分化的基因调控网络,又如何鉴定与神经退行性疾病和精神疾病相关的目标基因和细胞类型?它可以为您带来哪些更深入的见解?
那么,该实验是如何运行的?
为了了解这种双重处理如何进行,我们采访了两名参与开发单细胞多组学 ATAC + 基因表达的 10x Genomics 研发科学家:研究员 Kamila Belhocine 和资深计算生物学家 Shamoni Maheshwari。
我们了解到,Chromium 单细胞多组学 ATAC + 基因表达是从单细胞核悬液开始的。用转座酶对大量细胞进行转座,这种酶优先切割开放染色质区域中的核 DNA。然后将转座后的细胞核分成液滴,也称为 GEM,其中单个凝胶珠(Gel Bead)含有的 10x 条形码。在 GEM 内,条形码与单个细胞核内的 mRNA 和转座 DNA 片段相连接。孵育后,溶解 GEM 并混合,然后进行纯化、预扩增和文库构建。混合后的 GEM 制备出两个文库,一个用于 RNA 测序,另一个用于 ATAC 分析。
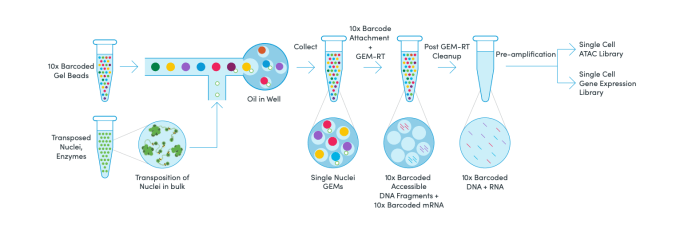
单细胞多组学 ATAC + 基因表达的流程。通过在简化的流程中综合基因表达和 ATAC-seq 的数据,获得转录图谱和染色质景观图谱的一体化视图。
在详细了解工作流程以及如何实现此技术之后,我们进一步了解了他们对使用多组学来解决生物学问题有何看法。
在开发 Chromium 单细胞多组学 ATAC + 基因表达时,您试图解决哪些研究问题?
Kamila:近年来,在单细胞水平测定基因表达让科学家能够前所未有地深入研究和了解生物学系统。许多基因表达的模式受到表观遗传程序的调控,这些程序由染色质可及性的变化所编码,可通过 ATAC-seq 来测定。然而,尽管各个细胞状态之间的染色质可及性差异很明显,并且很容易被检测到,但是如果不直接读出这些表观遗传变化对基因表达的影响,也很难解释它们。单细胞多组学 ATAC + 基因表达是先进商业化的解决方案,能够高精度阐释染色质可及性与基因表达之间的相互作用,从而以高分辨率了解健康与疾病状态下的基因调控。
您能介绍一下 Cell Ranger ARC 软件分析流程的强大功能吗?
Shamoni:人类基因组计划发现,人类基因组中的 1% 由基因组成。在接下来的十年,DNA 元件百科全书(ENCODE)计划确定了近 20% 的人类基因组具有潜在的调控功能。通过鉴定单细胞中的开放染色质位点和基因表达,Cell Ranger ARC 软件能够在这些潜在调控区域与转录组之间架起桥梁。
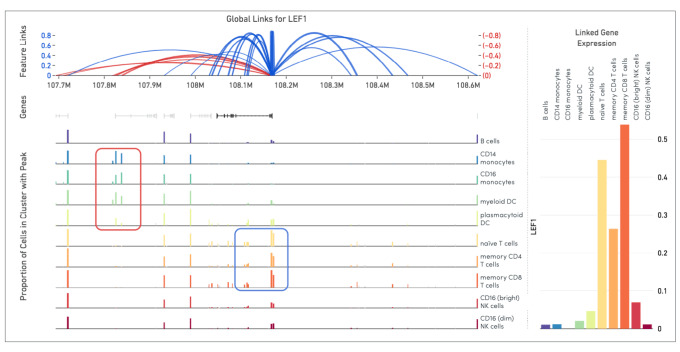
与目标基因直接关联的推定调控元件的鉴定。上图来自我们的 Loupe Browser 可视化软件,它是单细胞多组学 ATAC + 基因表达附带的数据可视化软件。上半部分您可以看到 LEF1 的整体关联,这些关联表示 1 Mb 窗口内与 LEF1 基因表达正相关(蓝色弧线)或负相关(红色弧线)的开放染色质峰,它是根据 7,273 个 PBMC 细胞核的样本绘制的。下半部分,根据不同细胞类型对 LEF1 表达水平和开放染色质峰进行彩色标注。蓝色框显示的是基因表达和开放染色质区域具有正相关的细胞类型。红色框显示的是基因表达和开放染色质区域具有负相关的细胞类型。
您们认为科学家现在可以实现哪些以往不可能的发现?
Shamoni:各种批量分析,如 ENCODE 所进行的分析,已经获得了人类基因组中调控元件的目录。如果将我们这种方法进一步应用在各种不同类型的样本和细胞上,研究人员就能够高精度解析某个调控元件在哪些细胞类型或状态中起作用及其目标基因的表达状态。
对细胞进行分类,其实是根据所观察到的基因表达谱的差异来划定某些意定的边界,据此将细胞划分入所谓的“细胞类型”中。但是我们知道,细胞在体内具有一系列连续的状态,其基因表达是受到多个表观遗传因素控制的结果。在同一细胞中同时进行基因表达和 ATAC 的分析,增加了有关细胞中基因表达程序的推定调控状态的信息,从而能够区分动态的细胞状态。
科学家有望完善对非编码变异的解释。GWAS 研究中鉴定出的大多数 SNP 位于非编码区。随之而来的挑战是解释这种遗传变异,并确定其功能靶点。如果非编码 SNP 落在开放染色质峰内,则这种分析有能力揭示推定的调控区域在特定类型的细胞中是否具有活性,以及它可能调控哪些基因。
Kamila:有了单细胞多组学 ATAC + 基因表达,科学家能够建立健康和疾病状态下基因调控的机制,更好地了解非编码区内遗传破坏的影响,为扩展知识库做出独特贡献,催生出改善人们生活的新型疗法。
看到科学家使用您们参与开发的产品进行探索,感受如何?
Kamila:作为产品开发人员,我们致力于了解用户的需求,并据此开发产品,以实实在在地满足这些需求。我总是非常惊喜的看到我们产品所带来的发现,以及其对疾病和发育的整体认识所产生的影响。我坚信,对生物学的深入理解将改善数百万甚至数亿人的健康和生活质量,随着每一篇使用我们开发产品的文献发表,我都认为 10x Genomics 为实现这一目标做出了有意义的贡献。
来源 10x Genomics
总之,单细胞多组学 ATAC + 基因表达可以:
▪ 加深对细胞类型和细胞状态的表征
▪ 结合表观基因组学和基因表达分析揭示以前被隐藏的新见解
▪ 通过一次实验中的多种读数加速对珍贵样本的研究
更多伯豪生物人工服务:


